中商情報網訊:透明質,又名玻尿酸,是一種酸性粘多糖,透明質酸以其獨特的分子結構和理化性質在機體內顯示出多種重要的生理功能,如潤滑關節,調節血管壁的通透性,調節蛋白質,水電解質擴散及運轉,促進創傷愈合等。
市場規模
根據Frost&Sullivan數據顯示,2019年,全球透明質酸原料市場銷量達到580噸,2016-2019復合增速約為20%,增長的驅動力主要為下游應用行業的需求大幅增長、以及透明質酸制造工藝的不斷突破。展望未來,2019-2024E年行業的復合增速預計為14.7%,在2021年達到620噸的市場銷量。
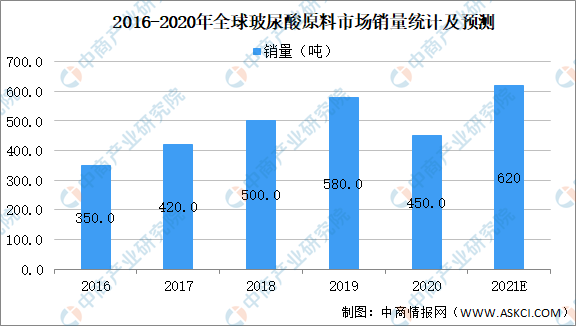
數據來源:Frost&Sullivan、中商產業研究院整理
應用占比
食品級玻尿酸主要用于各種營養補充食品、保健品中,在歐美發達國家普及度較高。化妝品級玻尿酸主要用于各種保濕類護膚品、彩妝以及日化產品中,對蛋白質含量有嚴格控制。醫藥級玻尿酸對于質量控制最為嚴格,企業在生產醫藥級玻尿酸時,需要經過GMP(藥品生產質量管理規范)的質量審核和穩定性考察,還需要藥廠生產許可證、藥品批準文號等,整個過程一般需要2-5年。但是另一方面,從售價和盈利能力來看,醫藥級產品也明顯高于其他品類。
數據顯示,2016-2020年全球玻尿酸原料市場銷量中占比最大的為化妝品級玻尿酸、其次為食品級玻尿酸,最后為醫藥級玻尿酸。
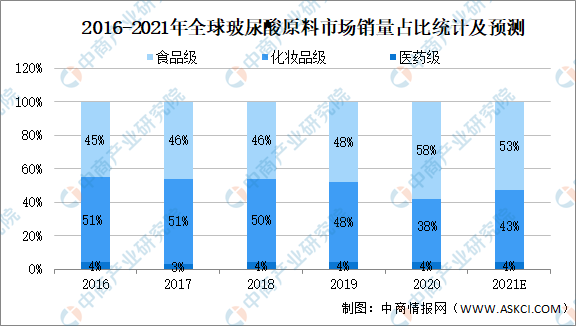
數據來源:Frost&Sullivan、中商產業研究院整理
行業監管政策變動情況
1.CFDA進一步加強對透明質酸類產品的監管
新版《醫療器械分類目錄》細化了醫療器械產品具體的管理類別,進一步規范了透明質酸類產品的分類及管理,提高了透明質酸類產品的注冊門檻,對透明質酸類產品的生產企業提出了更高的要求。根據新版《醫療器械分類目錄》,目前公司透明質酸終端產品的分類未發生變化,新版《醫療器械分類目錄》不會對公司目前的生產經營造成影響。對于新開發透明質酸類產品,公司將嚴格按照新版《醫療器械分類目錄》的要求進行研發和注冊。
2.歐盟醫療器材法規(MDR)將生效實施
新法規大幅提升有關醫材認證的規范與限制,增加醫材追溯性、臨床試驗規范嚴謹度、臨床證據的掌握度,增加上市后的產品安全性與效能監督。MDR施行后,生物醫用材料新品需嚴格按照新規進行認證;此前依照MDD及AIMD指令取得的認證證書將于2024年失效,因此已獲得認證的產品后續仍需重新申請CE認證,且必須開始收集自身產品于PMCF(上市后臨床跟蹤指南)的臨床監督證據。
MDR對生物醫用材料的產品質量要求顯著提高,產品制造商需要對其銷往歐盟市場的產品進行全面審查,以確定與MDR新規在分類、技術文檔、標簽和一般安全和性能要求(包括支持臨床證據)等方面的合規差距,并采取應對措施以確保產品CE認證的有效性。
3.原材料與制劑共同審評審批的政策變化影響
新藥及仿制藥研發需要投入大量的時間和成本,產品審評進度延誤或被否會對制劑企業造成經濟損失。關聯審批實施后,藥品原輔料的工藝質量研究水平和資料完善程度影響制劑的審評進度,因而制劑企業在新藥及仿制藥研發過程中,會主動對所涉及的原輔料及其生產企業開展充分的風險評估。為避免因原輔料問題造成的審批不確定性,制劑研發企業通常更傾向于選用“已激活”狀態的原輔料或此前已取得注冊號的原輔料進行關聯審批。未來,如同類型的原料藥/藥用輔料企業通過關聯審批并進入“已激活”狀態,并隨著企業數量的增加,可能會對發行人醫藥級原料的銷售業務造成不利影響。
更多資料請參考中商產業研究院發布的《中國玻尿酸行業市場前景及投資機會研究報告》,同時中商產業研究院還提供產業大數據、產業情報、產業研究報告、產業規劃、園區規劃、十四五規劃、產業招商引資等服務。
 如發現本站文章存在版權問題,煩請聯系editor@askci.com我們將及時溝通與處理。
如發現本站文章存在版權問題,煩請聯系editor@askci.com我們將及時溝通與處理。

