中商情報網訊:MAH制度于2015年起推出后,極大地促進我國醫藥行業的技術創新和質量體系的提高。對于研發機構來說,在MAH制度下可以作為上市許可持有人持有藥品批準文號,分別委托藥品生產企業進行生產和銷售企業進行銷售,從而獲得直接收益,增強企業研發動力,驅動研發人員創新積極性。
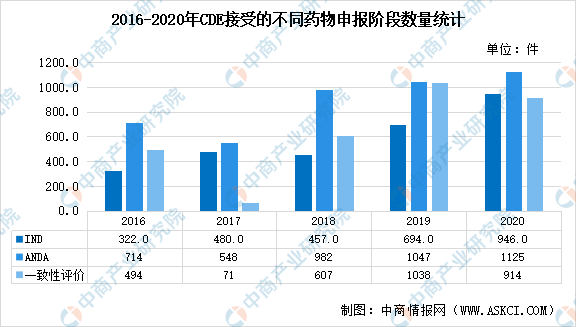
而IND、NDA、ANDA這三個縮寫是指新藥研發上市的不同階段,是美國FDA新藥申報程序的類型,在FDA官方網站上有詳細的解釋。IND是指新藥臨床研究審批,新藥的產生需要進行兩次行政審批,一是在臨床研究階段(IND申報),二是臨床研究完成注冊上市(NDA申報)。NDA是是指新藥經過臨床試驗后,申報注冊上市的階段。ANDA即仿制藥NDA申報。仿制藥是對創新藥的復制,仿制藥也要進行NDA申報,但仿制藥不需要進行臨床試驗,只需要證明其質量和療效與原研藥一致即可。藥物一致性評價,即國家要求仿制藥品要與原研藥品質量和療效一致。具體來講,要求雜質譜一致、穩定性一致、體內外溶出規律一致。從我國IND的申報情況上看,2020年達到946件;ANDA申報數量達1125件;一致性評價申報數量達914件。
數據來源:CDE、中商產業研究院整理
仿制藥一致性評價包括藥學一致性評價、BE試驗等過程。對絕大部分口服制劑和復雜注射劑而言,BE試驗是否等效是檢驗其有效性和安全性的關鍵。根據CDE公示的數據,中國BE試驗數量2020年達到了1117個。2015年以前,BE試驗僅維持慢增長趨勢,由于一致性評價推動,自此試驗數量每年大幅增加。從2015年至2020年,中國BE試驗年度數量從136個上升至1117個,增幅遠超整體臨床試驗。

數據來源:CDE、中商產業研究院整理
更多資料請參考中商產業研究院發布的《中國醫藥行業市場前景及投資機會研究報告》,同時中商產業研究院還提供產業大數據、產業情報、產業研究報告、產業規劃、園區規劃、十四五規劃、產業招商引資等服務。
 如發現本站文章存在版權問題,煩請聯系editor@askci.com我們將及時溝通與處理。
如發現本站文章存在版權問題,煩請聯系editor@askci.com我們將及時溝通與處理。

