中商情報網訊:非臨床研究指藥物研發研究,并非以人為受試對象進行的臨床試驗。該等非臨床研究涵蓋藥物研發過程的所有重要階段,包括藥物發現、臨床前及臨床試驗階段。藥物非臨床安全性評價(DSA)提供安全性數據,并為就候選藥物設計首次人體臨床試驗奠定基礎。
市場規模
中國的非臨床DSA市場的總收益于2015年約為138.0百萬美元,并于2019年增至415.7百萬美元,復合年增長率為31.7%,遠高于全球市場的復合年增長率。中國的非臨床DSA市場預計將在未來五年保持快速增長,2021年達至831.9百萬美元,復合年增長率為36.5%。
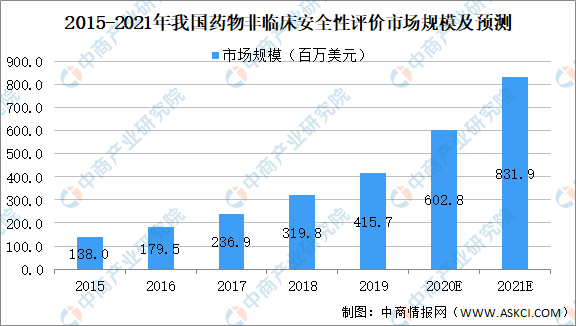
數據來源:中商產業研究院整理
未來發展趨勢
1.協同效應
由于非臨床DSA組織對候選藥物進行臨床前評價,其積累有關候選藥物的機構經驗和知識,并在設計和分析后續的臨床試驗時處于有利地位。通過提供臨床研發服務,DSA組織為客戶提供無縫一站式體驗以減少各種交易成本,從而為其提供有說服力的價值主張。此外,DSA組織因協調研發流程及利用其對候選藥物試驗的機構知識和經驗而實現更好的協同效應。
2.增值服務
專業團隊對潛在藥物的特性、安全性風險和危害有深刻的了解。因此,可就開展DSA向客戶提供見解,包括全面的藥物評價和后續研發建議,也可以有效的協助企業與客戶建立良好的關系。
3.行業整合
在我國,僅少數幾家具有較強能力提供符合國際標準的綜合服務的領先合同研究組織才能推動行業的發展。對于規模較小的市場參與者來說,通過為主要客戶開展日益復雜的項目來獲得市場份額變得越來越困難。因此,預期非臨床DSA行業將在未來進行整合,且領先的參與者預期將收購該行業中規模較小的參與者。
未來發展前景
1.規范審批流程,提高效率
中國政府已經發布多項監管政策,以進一步規范新藥臨床試驗申請審批流程。隨著治療性及預防性生物制劑藥物非臨床安全性評價詳細指導方針的出臺,中國藥物非臨床安全性評價日趨嚴格,符合人用藥品注冊技術要求國際協調會議的國際標準。因此,多年來,藥物非臨床安全性評價流程的整體效率一直在提高。
2.不斷增長的創新藥市場
中國制藥行業正處于從仿制藥轉向創新藥的戰略轉型期,且創新藥市場呈現出良好的增長態勢。與仿制藥和生物類似藥不同,創新藥需要進行非臨床安全性評價。隨著創新藥制劑的發展,非常規給藥途徑的范圍將擴大,例如通過眼睛、耳朵和鼻腔等特殊途徑給藥。因此,非臨床DSA服務提供商須擁有更強的藥物安全性評價實力。有關服務的發展將成為非臨床DSA行業的主要驅動因素。
3.不斷擴大的生物制劑市場
生物制劑對包括癌癥和慢性疾病在內的各類病癥具有出色的治療效果。中國的生物制劑市場正在迅速擴大,其復合年增長率領先于整個制藥市場。由于特殊的結構及特性,特別是細胞及基因療法,生物制劑具有特殊性及復雜性。因此,用于化學藥品的常規和常見非臨床DSA可能不完全適用于生物制劑。例如,用于基因和細胞療法的非臨床DSA包括對單次及重復給藥毒性試驗及免疫原性試驗進行的評價以及其他評價類型。
更多資料請參考中商產業研究院發布的《中國藥物非臨床安全性評價行業市場前景及投資機會研究報告》,同時中商產業研究院還提供產業大數據、產業情報、產業研究報告、產業規劃、園區規劃、十四五規劃、產業招商引資等服務。
 如發現本站文章存在版權問題,煩請聯系editor@askci.com我們將及時溝通與處理。
如發現本站文章存在版權問題,煩請聯系editor@askci.com我們將及時溝通與處理。

