中商情報網訊:創新藥是指具有自主知識產權專利的藥物。相對于仿制藥,創新藥強調化學結構新穎或新的治療用途。隨著政策環境的不斷優化,在國家對于中國自主創新藥的支持下,創新實力的不斷迭代,中國已然有不少創新品種正在加速走向世界。
市場現狀
1.市場規模
伴隨著創新藥審評審批等政策的出臺以及經濟快速發展帶來創新藥市場化提速,創新藥在醫藥市場結構的比重逐漸加大。2021年,在中國醫藥市場中,創新藥占比39.6%,我國也正在經歷“仿制藥-難仿藥-同類最佳-同類首創”的轉變與突破。數據顯示,2022年我國創新藥市場規模達6785億元,由于創新藥物相關政策利好、醫療保險調整、醫藥企業研發支出增加等,預計2023年中國創新藥市場規模將增長至7789億元。
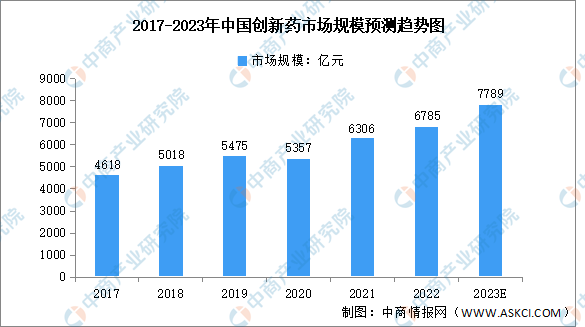
數據來源:弗若斯特沙利文、中商產業研究院整理
2.獲批數量
近年來,在政策的支持下,我國新藥審評審批不斷提速,創新藥正加速落地。2022年,NMPA共批準超40款創新藥上市,創新藥行業市場發展前景廣闊。隨著中國各新藥審評審批政策的協同執行,2021年新藥審評審批全面加速,新藥獲批數目創歷史新高,NMPA批準注冊的創新藥數量達83個。2022年上市創新藥數量回歸為49個。
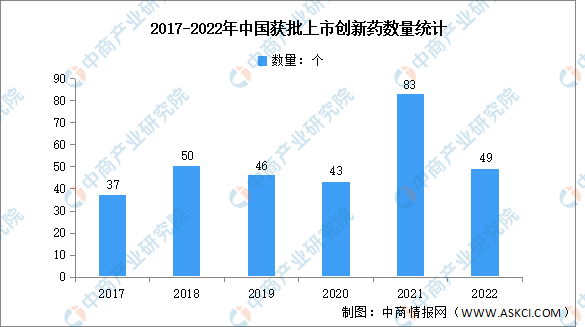
數據來源:醫藥魔方、中商產業研究院整理
發展前景
1.創新藥治療需求旺盛,市場持續擴容
創新藥仍然是藥品領域最有潛力的賽道之一。隨著我國人口老齡化進程加速、經濟水平提升、健康意識增強推升醫療需求,而創新藥是多種重大疾病主要解決方案,行業迎來發展機遇并快速發展。盡管創新藥板塊此前在政策、出海不利、疫情等壓力下出現波動,但隨著出臺的醫保政策趨于溫和、審評政策不鼓勵內卷、具有全球競爭力的品種的數量逐步增多,行業基本面出現邊際轉好,真正具備臨床價值和進度領先的產品有望強化市場優勢。
2.中國新藥上市加速通道種類與機制已經接近主要發達國家和地區
在審評審批效率方面,我國的審評審批速度曾經飽受詬病。經過一系列改革,目前我國在藥物的審評審批效率方面有了很大的改善。根據我國2020年新版《藥品注冊管理辦法》,目前我國有四個新藥上市注冊加速通道,包括:突破性治療藥物、附條件批準、優先審評審批和特別審批程序,對于有明顯臨床價值的新藥,縮短審評時限,并且提供相應的加速審評措施。目前,中國新藥上市加速通道在種類和機制上已經接近主要發達國家和地區。
3.新藥審評推進供給側改革,改善創新藥內卷
近年來,創新藥審評政策有望改善創新藥內卷環境,長期利好研發高順位企業。自2021年7月以來,CDE公開征求腫瘤藥物、單臂臨床試驗相關指導原則的意見,新藥審評政策趨向于:1)對隨機對照多中心試驗支持下的上市流程以及真正針對未滿足臨床需求的傾斜;2)壓縮仿創品種空間并大幅改善內卷競爭格局,類似PD-1/PD-L1抗體領域的激烈競爭導致的價格體系崩潰出現概率降低;3)長期有利于推動真正創新品種臨床的大范圍應用。
更多資料請參考中商產業研究院發布的《中國創新藥市場前景及投資機會研究報告》,同時中商產業研究院還提供產業大數據、產業情報、產業報告、行業白皮書、可行性研究報告、調查評估、產業規劃、園區規劃、產業鏈招商圖譜、產業招商指引、項目包裝策劃、產業招商&推介會等咨詢服務。
 如發現本站文章存在版權問題,煩請聯系editor@askci.com我們將及時溝通與處理。
如發現本站文章存在版權問題,煩請聯系editor@askci.com我們將及時溝通與處理。

